コニフェリンの高精度な分布可視化
D. AOKI, K. IWAMARU, S. NISHIDA, T. UCHIDA, B. LI, Y. ISOMURA, M. YOSHIDA, T. INAGAKI, K. FUKUSHIMA
Storage domains of coniferin in cell wall forming tracheid cells in Pinus thunbergii stems evaluated by cryo microscopic chemical analyses
Sci. Rep. 15, 38977 (2025)
DOI: 10.1038/s41598-025-22822-5
<この論文は大きく分けて2種類の実験法を報告しています>
植物がどのように細胞壁を作っていくのか。
これまで、様々なアプローチで分析が進められてきましたが、
特に生きている樹木の、まさに細胞壁を作っているその細胞だけを取ってきて、
その中身を化学分析する、というのは意外と難しいままでした。
これは、植物を切ってしまうと、細胞の中身が流れてしまうため、
厳密にどの細胞にあるのか、という位置情報を残せないためです。
そのため、当研究グループではこれまで、凍結した試料から薄い切片を切り出して、
その凍結切片に含まれる化合物を分析してきました。
この時、切片の乾燥重量をはかることで、細胞壁がもっとも薄い位置を決めていました。
しかし、顕微鏡で直接切るところを見たほうが、
どこから取ってきた細胞か確実なのではないか?ということで
霜がつかないように窒素置換した箱の中で、顕微鏡で見ながら切る、という
クライオマイクロダイセクション法(図1、2)に取り組みました。
これにより、細胞の成長段階に応じたその中身の変化について、
より詳細な定性・定量分析が可能になりました。
==========
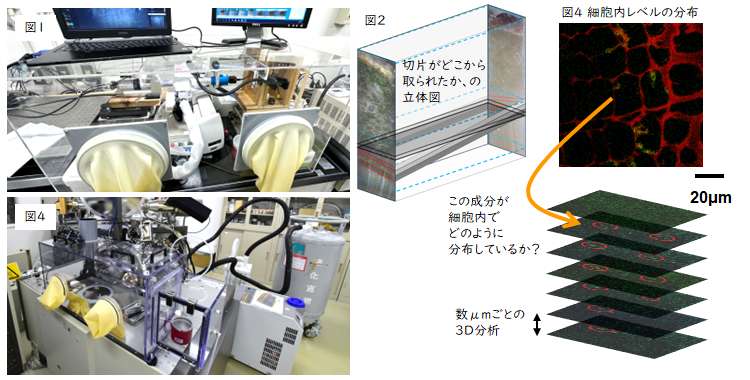
さらに細かいスケールで、ある細胞の中に、何らかの化合物があるとき、
この化合物は、細胞内で均一なのか、あるいは偏っているのかは重要です。
しかし、緑色蛍光タンパク(GFP)のような手法が使えない低分子化合物では、
細胞内レベルでの分布を見ることは大変難しいことでした。
そこで、3次元イメージングが可能な
ガスクラスターイオンビーム-二次イオン質量分析(GCIBーSIMS)に
凍ったままのサンプルを導入できるように準備(図3)して、分析しました。
結果(図4)より、ある成分(緑色)が、ひとつの細胞内に偏って存在しました。
さらに細胞の奥行方向への分析を繰り返すと、
数十μm以上にわたって、その成分が連続的に検出されました。
これにより、細胞内にこの成分(リグニン前駆体の配糖体、コニフェリン)の
貯蔵ドメインがあることを明らかにしました。

